【化学科講師向け】得意にしよう! 芳香族分離のポイントはここで解決!
芳香族分離は有機分野ではなく中和分野!?
芳香族分離は、有機の最低限の知識があれば、有機が苦手な人でも得意にすることが出来る分野です。
その最低限の知識とは、、、、
- アニリンは塩基性
- フェノール・芳香族カルボン酸(安息香酸やサリチル酸等)は弱酸性
- スルホン酸・ピクリン酸は強酸性
- 酸性度の高さは強酸≫芳香族カルボン酸>炭酸(H2CO3)>フェノール
- 他は全部中性
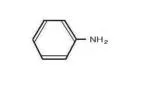
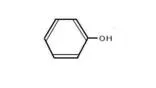
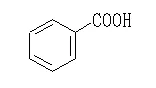
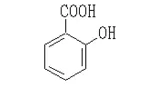
アニリン フェノール 安息香酸 サリチル酸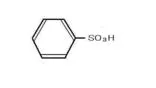
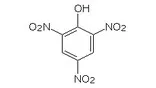
スルホン酸 ピクリン酸
これだけです!
さて次は芳香族分離の仕組みについて書いていきます。
中和されると溶ける!?
まず1つ目のポイントは、
芳香族は単体では水に溶けにくく、エーテルなどの有機溶媒に溶けやすいということです。
しかし、いったん安息香酸などが中和されて塩になると、
今度は水に溶けやすく、有機溶媒に溶けにくくなります。
このことを利用して、
最初はすべて有機溶媒にあった芳香族化合物を、少しずつ中和していき、分離していくのです。
芳香族は、単体は有機層に存在し、中和されてできた塩は水層に存在する。
弱いもの出て行け反応?(弱酸(or弱塩基)遊離反応)
2つ目のポイントは、中和分野で出てきた弱酸(or弱塩基)遊離反応です。
弱酸遊離反応と弱塩基遊離反応は、やることは同じなので、
ここでは芳香族分離に出てくる弱酸遊離反応について説明していきます。
弱酸遊離反応とは、
弱酸由来の塩(弱酸を塩基で中和してできた塩のこと)にそれより強い酸を加えることで弱酸が出てくる(化学用語で遊離と言います)という反応です。
具体例を挙げてみましょう。
弱酸である酢酸(CH3COOH)に塩基(NaOH)を反応させると
CH3COOH + NaOH → CH3COONa + H2O
の反応が起こり水と塩ができます。
この反応によってできた塩(CH3COONa)が弱酸由来の塩ということになります。
次に、この酢酸ナトリウムに酢酸より強い酸、例えばHClなどを加えると、
CH3COONa + HCl → CH3COOH + NaCl
の反応が起こって弱酸(酢酸)が出てくるのです。
この反応は弱酸の塩に強酸を加えると弱酸が出てくることから、
“弱いもの出て行け反応”と覚えましょう!
ここまでで、ひとまず必要な知識はそろいました。
ここからは具体例をあげて、理解を深めていきましょう。
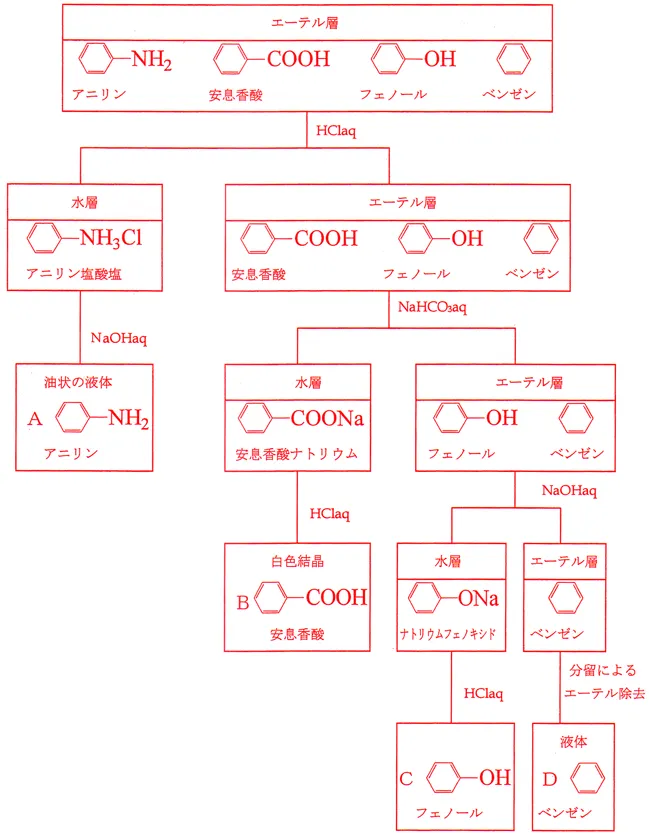
まず、アニリン、安息香酸、フェノール、ニトロベンゼンが混ざった有機溶媒があるとします。
アニリンは塩基性、安息香酸・フェノールは弱酸性、ニトロベンゼンは中性です。
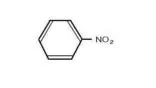
ニトロベンゼン
1、アニリンの分離
ここに、例えばHCl溶液(酸性)を加えたとすると、
塩基性のアニリンのみが中和されるので、アニリンだけが水に溶けるようになって水層に行きます。
この水層を取り除くことによって、まずアニリンの分離は成功です。
2、ニトロベンゼンの分離
次に、有機層に例えばNaOH溶液(塩基性)を加えたとすると、
酸性の安息香酸とフェノールが中和されて水層に行きます。
これで中和されずに有機層に残ったニトロベンゼンを分離することが出来ました。
3、フェノールの分離
最後に両方とも中和された安息香酸とフェノールの分離です。
今、この二つの物質はNaOHに中和されたので塩として水層にいます。
これが、“弱酸の塩”です。
この2つのどちらかを“弱いもの出て行け反応”を利用して遊離して有機層に戻すことが出来れば、
すべての物質の分離が成功することになります。
ここで酸性の強さが
芳香族カルボン酸(安息香酸)>炭酸>フェノール
の順番であったことを思い出してください。
フェノールにとって炭酸は“強い酸”なのに対して、安息香酸にとって炭酸は“弱い酸”になっています。
つまり、安息香酸の塩とフェノールの塩がある溶液に対し、CO2を吹き込むと、
CO2 + H2O → H2CO3
の反応が起こって炭酸が生じます。
“弱酸の塩”として働くことが出来るのは、炭酸より弱い酸のフェノールの塩だけ、ということになり、
フェノールが遊離し、有機層に戻ってくるのです。
これで、フェノールが有機層に、安息香酸の塩が水層にいるので、分離できたことになります。
以上のようにいろいろな芳香族化合物が混ざっていても、
中和を利用することである程度分離することが出来るのです。
中和を利用するので、
もちろん両方とも中性のニトロベンゼンとトルエンを分離することはこの方法ではできませんが。。。
トルエン
最後に
芳香族分離はまだほかにも、
フェノールと芳香族カルボン酸両方の性質を持つサリチル酸や炭酸の塩である炭酸水素ナトリウ(NaHCO3)などが出てくるバリエーションもありますが、
基本的なことは今回説明したことで網羅できているはずなので、今回のポイントは忘れないようにしましょう。
注意
'弱い方が反応する'と意識しすぎると間違えることがあるので、
必ず塩に対して強いか弱いかを確認しましょう。
【あわせて読みたい記事】
・【理科講師対象】大学入試頻出の中和滴定の重要ポイントを指導できるようになろう!
化学や理科系の質問をお持ちの読者の皆さん!
こちらで解決してしまいましょう!




![10円玉をピカピカにしよう!![高校化学]](https://www.juku.st/cdn/article_images/304/large_juku_entry_images_image.webp)